办事流程
合同说明
(一)合同签署流程和注意事项
1. 合同模版
(1)主合同模版
主合同是指申办方(和CRO)与我院签署的合同,涉及试验费用。
我院接受以下两种主合同模式:
A. 申办方和我院签署的两方主合同
B. 申办方、CRO和我院签署的三方主合同
主合同模版分为三种:
A.Ⅱ、Ⅲ、Ⅳ期药物临床试验主合同模版;
B.Ⅰ期/BE药物临床试验两方主合同模版;三方主合同模版;
C.器械临床试验主合同模板;
注:试验经费如涉及化疗药物配置、影像科刻盘存档及病理切片请关注附件
(2)CRC合同模版
CRC合同是指申办方/CRO、SMO和我院签署的合同,不涉及试验费用。
我院接受以下两种CRC合同模式:
A.申办方/CRO、SMO和我院签署的三方CRC合同
B.申办方、CRO、SMO和我院签署的四方CRC合同
2. 合同审核流程:
申办者/CRO递交立项资料的同时,即可发送合同初稿(申办方内部先与PI确认试验进度、费用部分,由申办方财务、法务审核通过后)进行初审。请在我院合同模板上以修订格式标出修改内容,以便我院快速审核。
(1)审核邮箱:
主合同:药物:(中英文)wcb2024@xwhosp.org,同时抄送 xwgcpht@xwh.ccmu.edu.cn
(我院模板)xwgcpht@xwh.ccmu.edu.cn
器械:zhuangjingwen@xwhosp.org
CRC合同:药物:xwgcp@xwh.ccmu.edu.cn
器械:zhuangjingwen@xwhosp.org
(2)审核文件
1)合同初稿;2)药监局试验批件/通知书(如适用);3) 保险凭证(如适用);4)方案。5)邮件正文中说明:本试验的进展情况——是否拿到伦理批件(或伦理上会/送审日期),目前处于什么阶段。
(3)审核反馈:机构办通常在7个工作日内反馈初审意见给申办者/CRO(电子邮件形式)。机构办初审合格后,如需发送我院法务和财务审核(法务和财务通常在5个工作日内反馈意见)。合同审核中的所有邮件往来,均需同步抄送PI。
注:若我方审核通过,形成定稿合同后申办方/CRO再行修改合同细则,我方将推迟20个工作日后进行再次审核!!
3. 合同签署:
申办者/CRO打印合同,申办方/CRO先盖章签字,再送至PI签字,最后送至临床研究管理办公室盖章签字。合同签署要求如下:
①合同务必采用双面打印,同时盖落款章和骑缝章。
②法人亲笔签署并注明日期,或提供法人亲笔签署的授权书。
③合同最终签署日期一定不早于伦理批件日期,申办者/CRO必须把控。
④如涉及人类遗传申请,则合同生效日期一定不早于人类遗传资源管理审批通过网上公示之后(合同中可对此进行约定)。
⑤完成签署《附件5:I期临床试验项目审核备案申请单(★适用于I期临床试验项目申请)》。
⑥CRC合同签署日期不早于主合同签署。
⑦合同签署份数:我院需要2份,1份存机构办,1份由CRA交予研究者。其余份数由申办方/CRO自行决定。
4. 入账(开具发票)手续办理
申办方/CRO办理经费转帐后,请复印1份合同,递交综合五楼504吕冠博老师,以便及时办理入账手续。联系电话:8319 8296 。试验经费从公司转出到我院办理入账,需要5-7个工作日。
机构办办理入账之后(以开具发票时间为准),试验经费才算正式打入我院,
申办方/CRO方可组织科室召开项目启动会后,第一例入组才能开始。
首都医科大学宣武医院临床试验机构
(二)临床试验费用计算方法
药物临床试验费用一般分为三个部分,第一部分为临床观察费,第二部分为受试者补偿费,第三部分为检查费。具体如下:
1.临床观察费
研究者劳务费 6.72%的增值税,20%管理费(扣除增值税后)。
例:拟给研究者发放10000元劳务费。公司实际支付的费用计算如下:
实际支付= 应发/【(1-6.72%)*(1-20%)】
13400.51= 10000/ 【0.9328*0.8】
则公司实际支付给研究机构的研究者劳务费为13400.51元
2.受试者补偿费 用于受试者交通和餐费等补贴
6.72%的增值税,20%管理费,及个人所得税。
个人所得税计算方法(计算结果保留小数点后2位)
(1)800元以下,不收个人所得税
(2)800元-4000元(不含4000元),
应发=(实发-160)/0.8
(3)4000-20000元(含4000元)
应发=(实发/5.25)+实发
例:拟给受试者发放1800元补偿费。公司实际支付的费用计算如下:
(1)加上个人所得税:应发=(1800-160)/0.8=2050
(2)加上增值税6.72%和管理费20%:
实际支付=应发/【(1-6.72%)*(1-20%)】=2050/【0.9328*0.8】=2747.11
因此公司实际要为每位受试者支付2747.11元。
3.检查费
用于受试者的检查以及医事服务费等。按实际发生计算。
6.72%的增值税,20%管理费。
例:根据我院检查费收费标准,某项临床试验的检查费共计3000元/例,加上3.36%增值税和20%管理费:
实际支付= 应发/【(1-6.72%)*(1-20%)】
4020.15=3000/【0.9328*0.8】
公司实际支付的检查费为4020.15元/例。
注意:
1.在撰写合同时,管理费、增值税、个人所得税全部融入到每项临床观察费中。管理费和增值税等的具体金额都不必单独体现(医院财务会自动计算)。详见合同模版。
2.上述所有费用均开具北京增值税专用/普通发票(票面税率6%)(发票项目:*研发和技术服务*临床观察费)。
首都医科大学宣武医院临床试验机构
(三)临床试验中英文合同注意事项
1.中英文合同必须要体现的内容
关注我院合同模板:中英文合同虽未采用我院合同模板,但合同起草者仍应仔细阅读我院合同模板,特别是经费预算部分,应满足我院财务管理要求。
(1)合同首页 :请参照我院临床试验中文合同首页制定中英文合同首页。
(2)本协议以中英文书写,如英文版本与中文版本有任何相冲突之处,以中文版本为准。本协议经各方授权代表签字并加盖各自公章或合同章后生效。本协议我院保存2份(研究者和临床研究管理办公室各1份)。
(3)必备文件保存:
药物试验:
收费标准:入组病例4000元/10例/10年,筛选失败病例200元/10例/10年,不足10例按照10例计算,一次性收取10年费用;若本试验在乙方未进行筛选(或已筛选但未入组受试者),保管费:共计1000元/10年,一次性收取10年费用。此费用在尾款结算时一并结清。
试验药物批准上市或未批准上市,申办者应及时将信息告知临床研究管理办公室。临床试验必备文件保管期限到期前90天,申办者通过邮件(机构邮箱:xwgcpht@xwh.ccmu.edu.cn)和电话(15699959047)联系临床研究管理办公室,商讨文件后续保存事宜。如到期未联系,且试验药物已满足批准上市后5年(未申请注册或未批准上市者,期限为试验终止后5年)的要求,则临床试验机构有权自行处理资料。
器械试验:
收费标准400元/文件盒/10年,未满一个文件盒按一个文件盒计算。一次性收取10年费用,此费用在尾款结算时一并结清。
试验器械/体外诊断试剂批准上市或未批准上市,申办者应及时将信息告知临床研究管理办公室。临床试验必备文件保管期限到期前90天,申办者通过邮件(机构邮箱:zhuangjingwen@xwhosp.org)和电话(15699959047)联系临床研究管理办公室,商讨文件后续保存事宜。如到期未联系,且医疗器械临床试验已完成或终止后10年,则临床试验机构有权自行处理资料。
(4)开票信息须注明:账户名称、纳税人识别号
(5)退款申请须注明:对于所有款项,如涉及退款,乙方均需扣除增值税和管理费。
(6)经费预算
以下表格为经费预算表模板,仅包括计划内访视费用,不包括计划外访视费用。计划外访视费需单独列表,也应明确研究者费用、受试者补贴和检查费。
①经费预算表
表1 预算表(金额为示例)
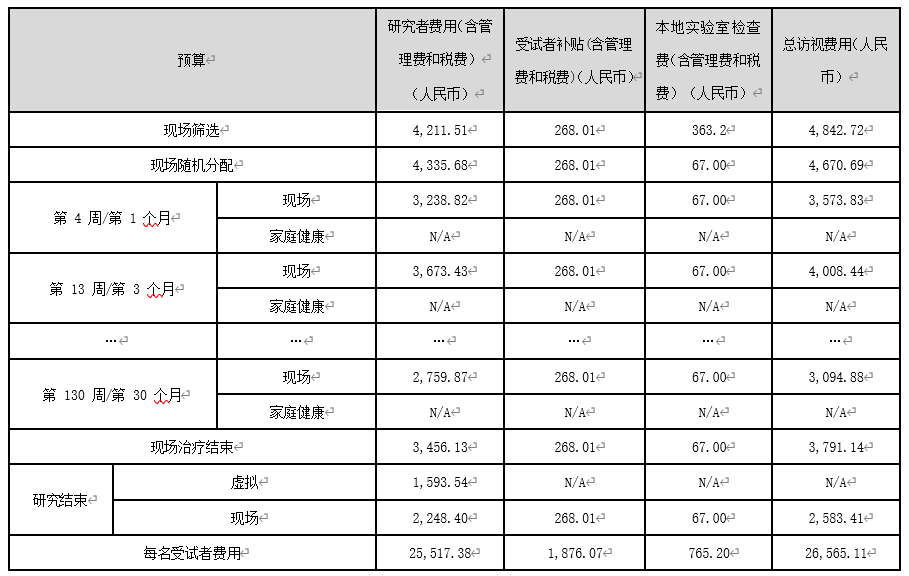
备注:
1.研究者费用涵盖研究医生费用、研究护士费用、影像刻盘费、病理切片费、化疗药配液费等。如涉及这些费用,建议细化研究者费用,并单独列表;
2.受试者津贴涵盖交通补助、采血补助等,如需细化,建议分开列出。受试者补贴仅计算了增值税,不需计算个人所得税,但要注明:如发生个人所得税,由申办者/CRO承担,在尾款结算时一并结算。
3.本地实验室检查费,可以另建一个表格, 列出每项检查的条目和费用。但在本表里,仅体现每次访视的检查总费用即可。
②预算总表和付款计划
按照我院财务管理要求,必须制作预算总表和付款计划。以下模板请参考,不适用的栏目可删除。
表2 预算总表和付款计划(金额为示例)
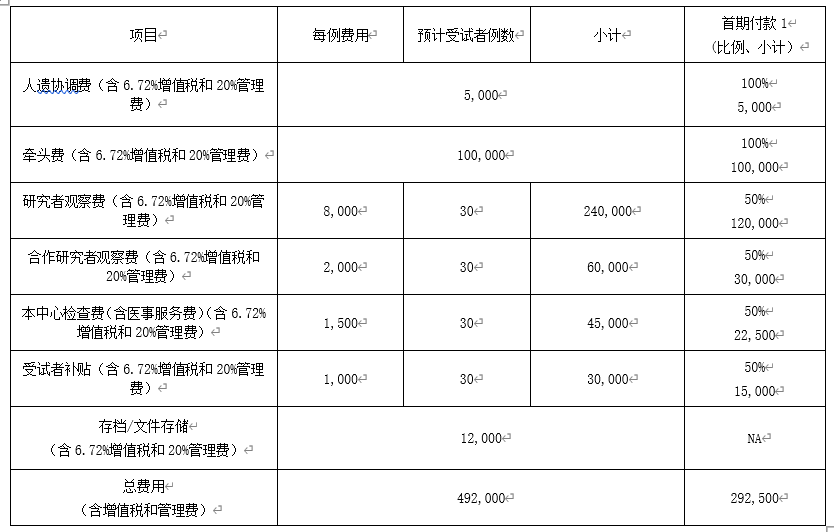
备注:
1.对于药物临床试验,首期付款,建议研究者观察费,受试者检查费和补偿费各支付50%。须写明:首期付款在启动会前支付,不要写具体时限。
如有特殊情况,可与机构办沟通,上述付款计划可根据各方需求调整。
付款周期:自首例受试者在研究机构入组之日起,每半年(或一年)为1个付款周期,根据费用实际发生情况支付。
尾款:本研究结束时,申办者和研究机构依据实际发生额和约定费率进行结算。
2.对于医疗器械临床试验,首期付款,观察费建议支付50%,检查费及补偿费建议支付100%,如有特殊情况,可与机构办沟通。
尾款:剩余款项及临床试验中实际发生的额外费用在试验结束后,分中心小结盖章前全部付清。
若存在中期分中心小结提交药监局的情况则会出现中期付款,中期付款需按实际产生的观察费、检查费和补偿支付相关费用,此费用可在主协议中约定,也可另行签署补充协议。
3.受试者补偿费,由我院财务处转给受试者,需缴纳增值税(6.72%)、20%管理费和个人所得税,具体计算方法见《临床试验费用计算方法》。个人所得税结算时按实际情况计算,不列入付款分期计划中。
4. 存档/文件存储费用尾款结算时按实际情况计算,不列入付款分期计划中。从归档当天开始计费。
首都医科大学宣武医院
临床研究管理办公室
2025年7月
附件1:药物临床试验两方主合同模板(适用于II、III、IV期及受试者为患者的I期)20250721已更新.docx
附件2:药物临床试验三方主合同模板(适用于II、III、IV期及受试者为患者的I期)20250721已更新.docx
附件3:药物临床试验两方主合同模板(适用于受试者为健康人的I期)20250721已更新.docx
附件4:药物临床试验三方主合同模板(适用于受试者为健康人的I期)20250721已更新.docx
附件5:I期临床试验项目审核备案申请单(★适用于I期项目立项时使用).docx
附件7:药物临床试验必备文件保存补充协议 20250721已更新.docx
附件10:临床试验《医学影像科刻盘》申请流程(需要刻盘).docx
附件11:临床试验《病理科》申请流程(需病历切片).docx
附件12:临床试验《化疗药配置》申请流程(需要化疗药配置).docx










